据韩国生物制药业界5日消息,生物制药公司赛尔群将于13日出席在大韩药学会主办的“2021 High1 新药开发研讨会”,并公布新冠药物CT-P59(成分名Regdanvimab)的全球第二期临床试验结果。
此前,赛尔群曾在临床试验结束后向食品医药安全处申请有条件许可,并未对外公开详细的临床数据。考虑到韩国国产新冠疫苗受到全民关注,应食品医药安全处要求,在有新指示之前,赛尔群将不对外公开数据。由于临床结果不明确造成民众担忧,因此政府决定公开结果。
赛尔群相关人士表示,公司就是否早日公开临床数据与食品医药安全处紧密协议,最近食品医药安全处同意公开结果,借此次参加学会之际将作详细报告。该人士还强调,CT-P59的治疗效果显著、安全性高,用药时可以明显降低向患者向重症转换的比例,已经获得国内外专家的认可。
第二期临床试验在韩国、罗马尼亚、西班牙、美国等面向327名不同症状患者为对象进行,赛尔群于去年11月25日结束用药,12月29日向食品医药安全处申请有条件许可。在申请许可的同时,赛尔群还将在全球10余个国家和地区进行第三期临床试验。
据食品医药安全处消息,除赛尔群外,SK Bioscience等韩国其他制药公司也快马加鞭,力争实现年内完成三期临床试验的目标。去年11月,SK Bioscience的新型冠状病毒疫苗备选物质“NBP2001”已经获得许可进入一期临床试验。去年5月,SK Bioscience还获得盖茨基金会支持,与美国华盛顿大学抗原设计研究所共同开发的新冠病毒疫苗备选物质“GBP510”也即将进入临床试验。
Genexine为应对疫苗变异,将疫苗备选物质从“GX-19”更新为“GX-19N”,并于去年12月11日获得食品医药安全处许可进入1/2a期临床试验。Gene One生命科学开发的“GLS-5310”,于1月4日完成1/2a期临床试验首例接种;CELLID开发的“AdCLD-CoV19”也于去年12月4日获得进入1/2a期临床试验许可;国立传染病研究所最近与莫德纳公司就新冠病毒疫苗备选物质开发达成协议,韩国也可以以信使核糖核酸(mRNA)方式开发疫苗。
中央防疫对策本部第二副本部长权埈郁最近表示,“韩国目前进行新冠疫苗开发平台中并没有mRNA疫苗,然而全球范围内开发并得到紧急使用批准、实际接种的两种疫苗——辉瑞与莫德纳疫苗均为mRNA疫苗。mRNA疫苗对韩国来讲算是不毛之地,作为促进疫苗及治疗药物开发的促进委员长兼国立保健院长,感到十分开心的同时也感到责任重于泰山。国产疫苗开发由于时间短,又缺乏经验,开发过程难免出现反复,希望今年下半年可以完成三期临床试验。”
目前韩国政府已经分别与阿斯利康签署采购1000万人份疫苗合同,杨森(600万人份)、辉瑞(1000万人份)、莫德纳(2000万人份)等共确保5600万人份的新冠疫苗,阿斯利康从一季度、杨森与莫德纳从二季度、辉瑞从三季度开始供应。
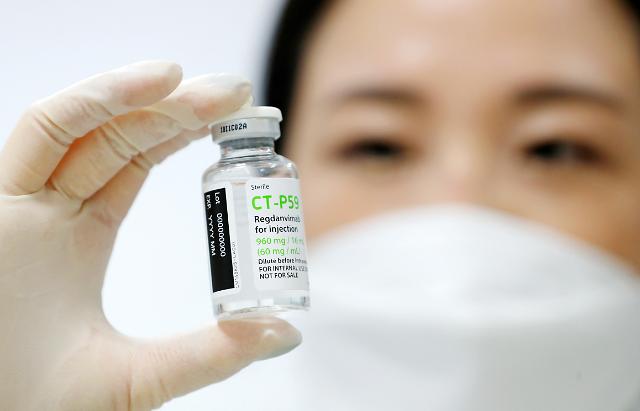
【图片提供 韩联社】